重点实验室发现深海细菌多糖通过靶向I型胶原蛋白抑制肿瘤转移
8月27日,国际学术期刊Journal of Biological Chemistry刊发了题为“Marine bacterial exopolysaccharide EPS11 inhibits migration and invasion of liver cancer cells by directly targeting collagen I”的文章,报道了中科院实验海洋生物学重点实验室孙超岷课题组关于深海细菌多糖EPS11通过直接靶向I型胶原蛋白抑制肝癌细胞黏附、迁移和侵袭,进而抑制肿瘤细胞转移的研究成果,为发展抗肿瘤转移药物提供了新型靶点和候选前体,也为进一步开发深海微生物资源提供了研究范例和方向。
很多天然多糖具有显著的抗癌活性,且对人体的毒副作用较小,被认为是合成抗肿瘤药物的良好替代品,在肿瘤治疗领域引起广泛关注,但多糖复杂多样的化学结构使得深入研究其相应作用机制异常困难。相比于植物多糖,微生物多糖研究较少;在微生物多糖中,深海微生物多糖研究更是处于刚起步阶段。早在2016年,孙超岷课题组基于中科院海洋所“科学”号科考船采集的一批深海样品分离到了一株芽孢杆菌Bacillus sp. 11,经过初步研究,发现该菌株能产生有明显抗肿瘤活性的多糖EPS11。经过近五年的系统研究,研究团队先后厘清了EPS11多糖的基本化学结构及抗肺癌机制,发现EPS11具有显著的抑制肿瘤生长和转移的双重活性,并分别与一种灵芝萜类抗肿瘤化合物GL22及抗肝癌临床药物索拉菲尼具有良好的协同作用,但EPS11多糖抗肿瘤转移的作用靶点及相关机制仍不清晰。
为此,课题组进一步结合蛋白组学、细胞热位移分析、表面等离子体共振等手段,发现EPS11抗肿瘤转移的直接作用靶标为I型胶原蛋白,进而结合基因表达和功能阻断技术阐释了EPS11通过靶向I型胶原蛋白-β1整合素信号通路抑制肿瘤转移的分子机制。众所周知,肿瘤转移是绝大多数肿瘤病人死亡的主要原因,EPS11多糖高效、低毒的抗肿瘤转移活性使其有望成为极具应用潜力的多糖类抗肿瘤转移候选药物。此外,孙超岷研究团队近年来围绕深海微生物多糖抗肿瘤、抗多重耐药菌机制及生物合成调控等方面取得了系列进展,获得了多个有应用潜力的多糖类药物前体。其中,抗肿瘤转移多糖EPS11已经完成了作用机制解析、动物实验、规模化中试发酵生产等系列工作,为药物开发奠定了坚实基础。
中科院实验海洋生物学重点实验室助理研究员刘格博士为第一作者,孙超岷研究员为通讯作者。研究得到了国家自然科学基金委青年项目、大洋协会“深海生物资源计划”等项目联合资助。
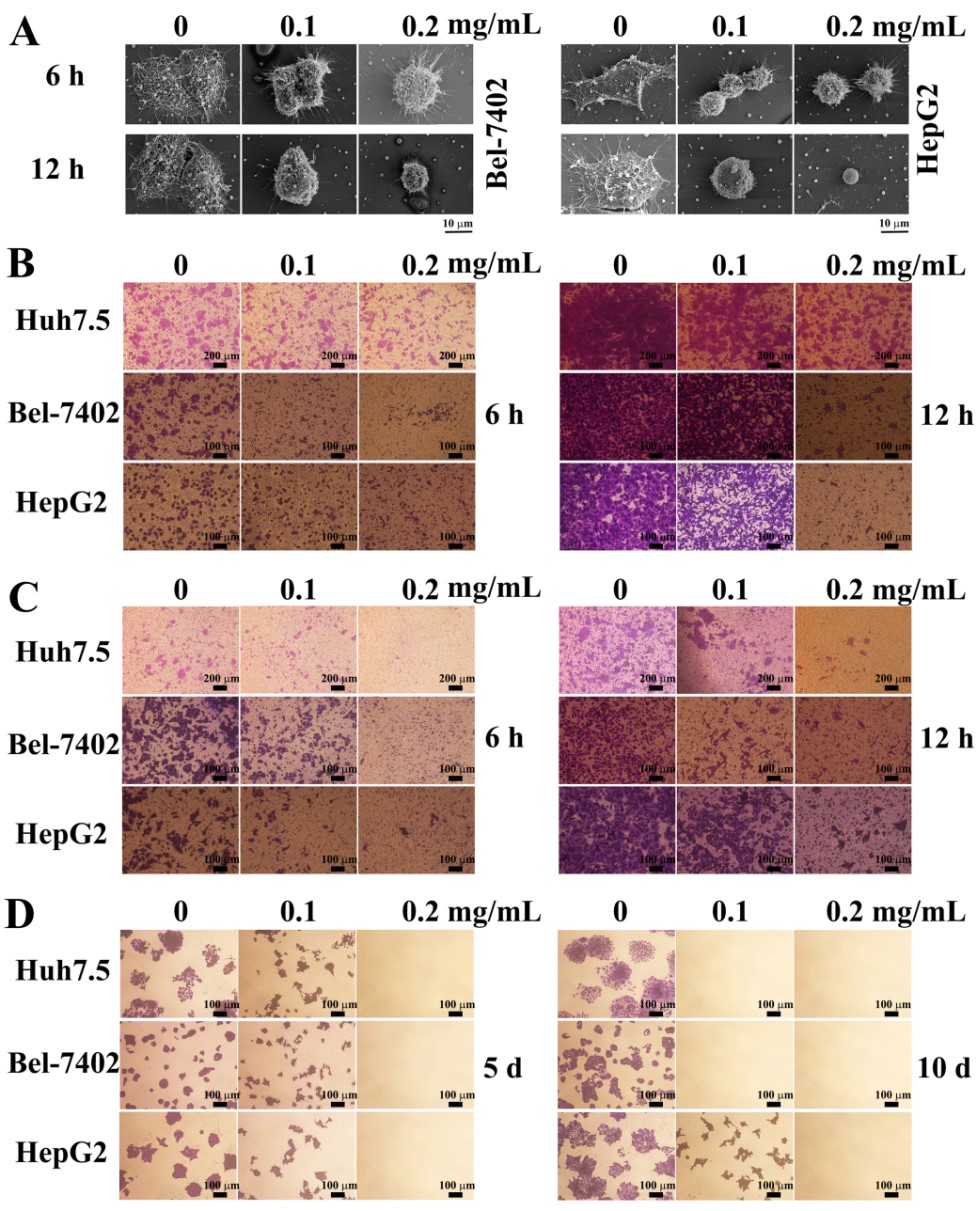
EPS11抑制肿瘤细胞的粘附、迁移、侵袭和克隆形成
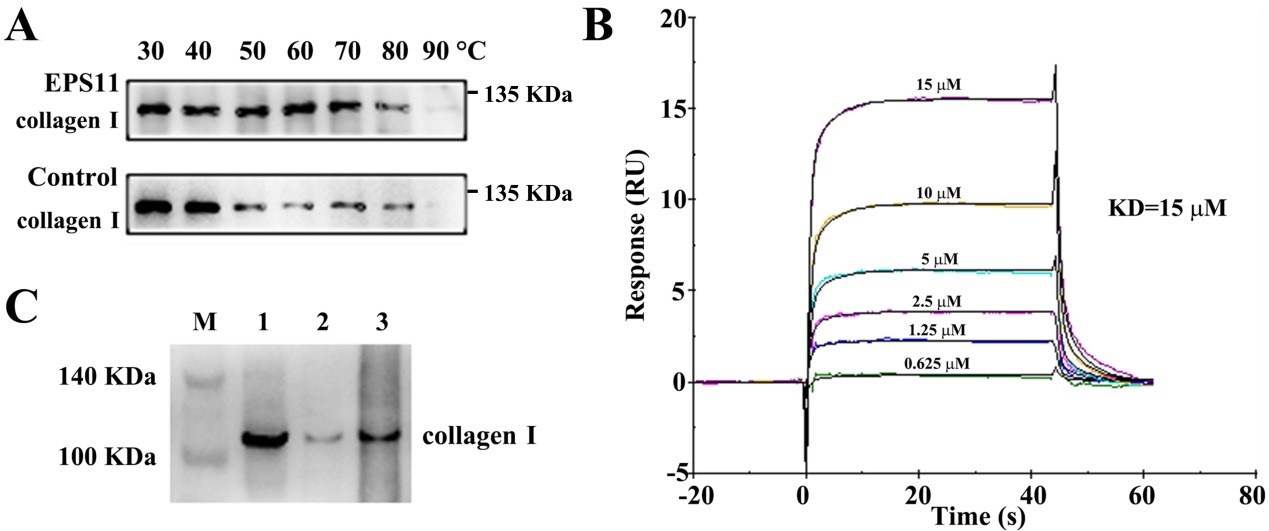
多种途径确定EPS11的直接作用靶标为I型胶原蛋白
Ge Liu, Rui Liu, Yeqi Shan, Chaomin Sun*. Marine bacterial exopolysaccharide EPS11 inhibits migration and invasion of liver cancer cells by directly targeting collagen I. Journal of Biological Chemistry, 2021, doi: https://doi.org/10.1016/j.jbc.2021.101133.
论文链接:https://www.jbc.org/article/S0021-9258(21)00934-0/fulltext.
附件下载:
 鲁公网安备37020202001323号
鲁公网安备37020202001323号 